Comparación de modelos cinéticos isotérmicos durante la adsorción de plomo mediante Azolla caroliniana*
Hugo Romero-Bonilla**
https://orcid.org/0000-0002-7846-0512
Universidad Técnica de Machala, Facultad de Ciencias Químicas
y de la Salud, El Oro, Ecuador
Juan Carlos Luque Vera
https://orcid.org/0000-0002-8901-7110
Universidad Técnica de Manabí, Facultad de Agronomía, Portoviejo, Ecuador
Andrés Castillo Sánchez
https://orcid.org/0000-0002-8053-2343
Universidad Técnica de Machala, Facultad de Ciencias Químicas
y de la Salud, El Oro, Ecuador
Washington Espinoza Ramón
https://orcid.org/0000-0003-4151-2347
Universidad Técnica de Machala, Facultad de Ciencias Químicas
y de la Salud, El Oro, Ecuador
Luis Olivera Montenegro
https://orcid.org/0000-0002-0151-7031
Universidad Ignacio de Loyola, Ingenieria de Industrias Alimentarias
Lima, Perú
Recibido: 2 de marzo 2022 / Aprobado: 23 de marzo de 2022
doi: https://doi.org/10.26439/ing.ind2022.n42.5792
RESUMEN: Los metales pesados constituyen un riesgo para la salud pública de las poblaciones que consumen agua contaminada por estos elementos químicos. En este sentido, el tratamiento de aguas residuales que incorpore la remoción de iones metálicos es causa de múltiples investigaciones a nivel mundial. El objetivo de esta investigación fue determinar la capacidad de remoción del plomo (Pb) presente en aguas sintéticas y la intensidad de adsorción del helecho Azolla caroliniana por este metal. Se utilizó un espectrofotómetro de absorción atómica para determinar la concentración del plomo adsorbido. A partir del gráfico de isotermas de Langmuir se determinó que, para los 4 reactores utilizados, el tipo de sistema isotérmico era desfavorable para esta isoterma (RL’s mayor a 1). Por su parte, las gráficas de las isotermas de Freundlich para los 4 reactores permitieron establecer los modelos lineales del comportamiento cinético de la adsorción de plomo mediante Azolla caroliniana, obteniendo el mejor R2 y la mayor intensidad de adsorción (n) de Pb (0,122) para el reactor D (30 ppm de Pb).
Palabras clave: Azolla caroliniana / absorción / biorreactor / remoción

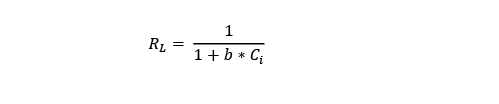
ABSTRACT: Water contaminated by heavy metals is a risk to public health. This is the reason behind widespread research on water treatment oriented to removing metal ions. This research determined the intensity of adsorption of lead (Pb) by the Azolla caroliniana fern and its capacity to remove lead in synthetic waters. An atomic absorption spectrophotometer was used to determine the concentration of adsorbed lead. Langmuir isotherm graphs showed that the type of isothermal system was unfavorable for the four reactors used in the study (RL's greater than 1). On the other hand, Freundlich isotherm graphs showed the linear models of the kinetic behavior of lead adsorption by Azolla caroliniana for the four reactors and enabled us to determine that the best R2 and the highest adsorption intensity (n) of Pb (0,122) was achieved with reactor D (30 ppm Pb).
Keywords: azolla caroliniana / absorption / bioreactor / removal
* Todos autores han contribuido con la misma intensidad en el diseño, obtención de datos, analisis, revisión crítica de su contenido y aprobación final de la versión publicada.
** Correos electrónicos en orden de aparición: [email protected]; [email protected]; [email protected]; [email protected]; [email protected]
1. INTRODUCCIÓN
El hallazgo en aguas residuales, ya sean urbanas o industriales, de iones de metales pesados muy nocivos, tales como el plomo (Pb), es un grave problema para el medio ambiente con una creciente muy preocupante, porque aún en bajas concentraciones son tóxicos (Maldonado et al., 2012).
El plomo es considerado como un potente contaminante del medio ambiente, afecta a la atmósfera, al suelo y al agua. Las emisiones de plomo más importantes se dan en la minería, en la industria metalúrgica y en los procesos de transformación de este metal para su uso industrial (Sharma & Dubey, 2005).
Dentro de la industria, los compuestos más importantes son los óxidos de plomo y tetraetilo de plomo. Ya que estos pueden encontrase en industrias de vidrio y cerámica, refinación del petróleo, fabricación de baterías y en operaciones mineras (Altamirano Pavón, 2015).
El plomo aunque se encuentre en bajos niveles de exposición llega a ser tóxico para el organismo, si se encontrase plomo en los líquidos biológicos, quiere decir que ha ingresado de manera externa en nuestros alimentos y/o a la exposición de este metal sin la debida protección (Rodríguez et al., 2016).
Debido a su toxicidad, la Agencia de Protección Ambiental de EE. UU. (EPA) ha fijado un máximo nivel de concentración de iones de Pb para el agua potable de consumo humano, que es de 0,015 mg/L; en México, la Ley General de Salud en Materia del Control Sanitario de las Actividades, Establecimientos, Servicios y Productos tiene como reglamento o establece 0,05 mg/L de plomo límite de concentración en agua para consumo humano. La investigación sobre el Pb es un tema de gran interés en la actualidad, por cuanto se desconoce su uso biológico, debido a que es muy tóxico para la mayoría de los seres vivos (Altamirano Pavón, 2015).
La mayoría de las plantas absorben metales pesados del suelo y esto depende de la especie vegetal a la que pertenezca (Shmaefsky, 2020). La entrada de metales pesados en las plantas es esencialmente producida a través de la raíz. Tal absorción se produce como efecto del gradiente de potencial electroquímico de la membrana del plasma en las células de las raíces de las plantas, lo cual conduce a los cationes al interior de dichas células (Sánchez et al., 2011).
La utilización de biomasa de algas, hongos y bacterias como material adsorbente se considera como una alternativa viable para la remoción de contaminantes desde aguas residuales (Tejada-Tovar, Villabona-Ortiz, & Garcés-Jaraba, 2015). Estos procesos de adsorción e intercambio iónico son considerados como una alternativa muy eficiente. Sin embargo, la eliminación de los metales en los medios, donde hay considerable volumen de agua, puede ser algo costoso y desafiante, debido al lugar y a los tipos de metales que están presentes. Los metales pesados son responsables de diversos riesgos para la salud en seres humanos, pertenecientes a su propiedad de persistencia y bioacumulación (Rai, 2008). Cabe mencionar, la importancia de la bioadsorción es que por ser una “tecnología limpia” puede ser utilizada en procesos de remediación del ambiente, para remover metales y descontaminar las aguas residuales, para posteriormente poder ser devueltas a los distintos afluentes (Dávila Molina & Bonilla, 2011).
Adicionalmente, los métodos convencionales para la recuperación de metales de aguas residuales diluidas (p. ej., precipitación química, intercambio iónico, evaporación, galvanoplastia, intercambio iónico y procesos de membrana) son ineficientes, tienen un alto costo por kilogramo recuperado y requieren altos reactivos/energía (Ahmady-Asbchin et al., 2012).
En este sentido, la Azolla sp. se presenta como una oportunidad sostenible de remediación de metales pesados en agua, debido a que se ha encontrado que remueve entre 38 % y 50 % de la concentración inicial de cromo al tercer día y alcanza un 63 % de remoción total en el intervalo de concentraciones estudiadas.
Así mismo, la Azolla es un helecho acuático con los siguientes grupos funcionales orgánicos: O–H y N–H, lo que indica la presencia tanto de grupos hidroxilo libres, grupos C–H de los grupos metileno (–CH2) y grupos metilo (–CH3); C = O del carboxilato (–COO–); N–H de los grupos amida I. Esto sugiere que los grupos amida, hidroxi, carboxilato y C–O podrían participar en la biosorción en la superficie de Azolla debido a los cambios en los números de onda, que resultan del cambio en la energía de enlace en estos grupos funcionales correspondientes. Este estudio indica que el helecho acuático Azolla, que está ampliamente disponible a bajo costo, puede usarse como un material biosorbente eficiente para el tratamiento de iones de cobre y níquel en aguas residuales. La isoterma de adsorción de iones de cobre y níquel por piezas secas de este helecho podría describirse adecuadamente mediante el modelo de isoterma de Langmuir. La máxima capacidad de adsorción fue de 0,77 y 0,54 mmol/g para iones de níquel y cobre, respectivamente (Ahmady-Asbchin et al., 2012).
La bioadsorción de metales pesados en soluciones acuosas es considerada una alternativa dentro de la tecnología en el tratamiento de aguas de desecho industrial. La cantidad de metales pesados absorbidos depende no solo del tipo de material absorbente que se utiliza, sino de los tipos de iones metálicos, su temperatura, concentración, pH, fuerza iónica y el efecto de otros metales presentes en dicha solución (Pérez et al., 2018).
En este sentido, se trata de la transferencia selectiva de uno o más solutos desde una fase líquida a partículas sólidas de material biológico e involucra mecanismos químicos y hasta físicos en este proceso (Vizcaino Mendoza & Fuentes Molina, 2015). Los componentes estructurales de los materiales usados en la biosorción contienen moléculas como proteínas, polisacáridos o nucleótidos con diversos grupos polares, entre ellos carboxílicos (COOH), aminos (NH), fosfatos (PO4), tioles (SH) e hidroxilos (OH), con capacidad de enlazar al ion metálico por atracción de cargas opuestas (Saeed et al., 2005).
Así mismo, la biosorción posee una amplia gama de ventajas, comparada con técnicas convencionales, las cuales son: intercambio iónico, precipitación química, filtración por medio de membranas, floculación/coagulación, tratamiento electroquímico, ozonización, etcétera (Tejada-Tovar, Villabona-Ortiz, & Garcés-Jaraba, 2015).
Uno de los parámetros a tener en cuenta dentro de la biosorción es el pH, ya que este puede afectar a la solubilidad de los distintos metales pesados o activación de grupos funcionales al interior de la biomasa (Vallejo, 2021). Adicionalmente, los diferentes estudios cinéticos de procesos de biosorción permiten conocer o determinar su velocidad de fijación de los distintos metales en el biosorbente, en un tiempo dado (Siccha, 2012).
Este mecanismo cinético es muy complejo, pudiendo dar interacciones o reacciones entre los distintos grupos funcionales del biosorbente y el soluto, hay que tener en cuenta todos los procesos de transferencia de materia, los cuales son transportes de especies de la fase líquida hasta la superficie del sólido (Siccha, 2012).
El objetivo de la presente investigación fue determinar el tipo de sistema isotérmico que gobierna el proceso de adsorción de soluciones sintéticas de plomo mediante Azolla caroliniana.
2. MATERIALES Y MÉTODOS
Se aplicó un método experimental, para lo cual se recolectó el helecho de una laguna local para proceder a lavarlo con agua destilada. Las concentraciones de las disoluciones de plomo fueron de 10, 15, 20 y 30 ppm (reactores A, B, C y D, respectivamente) en un litro de agua desionizada, cada una con 24 g de helecho. Se tomaron alícuotas de 10 ml de muestra por cada media hora, durante un lapso de 2,5 horas, para las distintas determinaciones de la biosorción de plomo. Las muestras recolectadas se analizaron con un equipo de espectrometría de absorción atómica (AAS), para determinar la concentración del metal en el equilibrio y poder graficar y establecer el comportamiento de las isotermas de Langmuir y de Freundlich. También se realizaron mediciones de pH a los 4 reactores.
Mediante la ecuación (1) se calculó la concentración de equilibrio para cada uno de los diferentes reactores:

Donde Ce es la concentración de equilibrio, Cinicial es concentración inicial y Cfinal es concentración final de plomo en cada reactor en ppm.
Posteriormente, se procedió con el cálculo de la capacidad de absorción mediante la ecuación del modelo Freundlich (2):

Donde q es la cantidad de soluto que es absorbido por la biomasa para cada uno de los reactores en un tiempo determinado (mg de metal/g de biomasa), Ce es la concentración en equilibrio; K indica la capacidad de adsorción en la fase de solución; n es el parámetro asociado a la intensidad de la adsorción (Herrejón et al., 2008).
Luego, se procedió con el cálculo de la capacidad de absorción mediante la ecuación del modelo de Langmuir (3).

Donde q es la cantidad de soluto que es absorbido por la biomasa para cada uno de los reactores en un tiempo determinado (mg/g); qmáx. es la capacidad máxima de adsorción (mg/g), Ce es la concentración en equilibrio; b es el parámetro de la ecuación relacionada con la afinidad del biosorbente por los iones de Pb.
Podemos evaluar la isoterma de Langmuir con el factor asimétrico RL (4), el cual nos permite determinar el tipo de sistema isotérmico (véase la tabla 1).

Tabla 1
Valores para determinar el tipo de sistema isotérmico
|
RL = 0 |
Sistema isotérmico irreversible |
|
0 < RL < 1 |
Sistema isotérmico favorable |
|
RL = 1 |
Lineal |
|
RL > 1 |
Sistema isotérmico desfavorable |
Finalmente, se determinó una relación entre la concentración de equilibrio con respecto a la capacidad de absorción (g/L) para graficar las isotermas de Langmuir y Freundlich que fueron obtenidas para cada reactor.
3. RESULTADOS
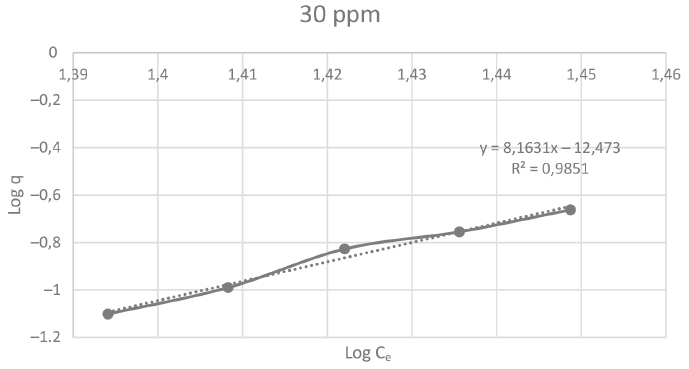
La tabla 2 muestra los valores de K y n para los 4 reactores con concentración de plomo de 10, 15, 20 y 30 ppm, los cuales fueron obtenidos mediante el uso de la ecuación 2 de la isoterma de Freundlich.
Tabla 2
Resultados de la isoterma de Freundlich para la adsorción de Pb en los 4 reactores
|
Isotermas de Freundlich |
||||
|
|
10 ppm |
15 ppm |
20 ppm |
30 ppm |
|
Ecuación de la isoterma |
y = 19,71x − 20,423 |
y = 24,845x − 30,144 |
y = 15,943x − 21,115 |
y = 8,1631x − 12,473 |
|
R2 |
0,9421 |
0,9237 |
0,8397 |
0,9851 |
|
Ordenada |
−20,423 |
−30,144 |
−21,115 |
−12,473 |
|
Pendiente |
19,719 |
24,845 |
15,943 |
8,163 |
|
K |
3,7572E-21 |
7,17794E-31 |
7,67361E-22 |
3,36512E-13 |
|
n |
0,051 |
0,040 |
0,062 |
0,122 |
En la tabla se presentan los valores de intensidad de adsorción (n) de Pb en la biomasa, siendo el mayor (0,122) para el reactor D (30 ppm de Pb).
A continuación, se muestran las figuras 1, 2, 3 y 4 que corresponden a las isotermas de Freundlich para las concentraciones de 10, 15, 20 y 30 ppm de Pb respectivamente. En ellas se pueden observar que el mayor coeficiente de correlación (0,9851) lo obtuvo la isoterma con concentración de 30 ppm.
Figura 1
Isoterma de Freundlich para el reactor A

Figura 2
Isoterma de Freundlich para el reactor B
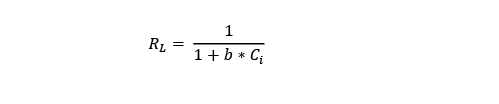
Figura 3
Isoterma de Freundlich para el reactor C
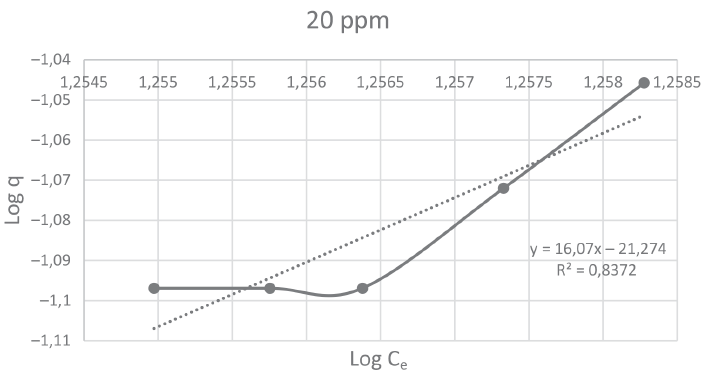
Figura 4
Isoterma de Freundlich para el reactor D
La tabla 3 muestra los valores de qmáx. y b para los 4 reactores con concentraciones de Pb de 10, 15, 20 y 30 ppm, los cuales fueron obtenidos mediante el uso de la ecuación 3 de la isoterma de Langmuir.
Tabla 3
Resultados de la isoterma de Langmuir para la adsorción de Pb en los 4 reactores
|
Isotermas de Langmuir |
||||
|
|
10 ppm |
15 ppm |
20 ppm |
30 ppm |
|
Ecuación de |
y = 10252x − 1025 |
y = 11063x − 744,12 |
y = 3411,8x − 176,92 |
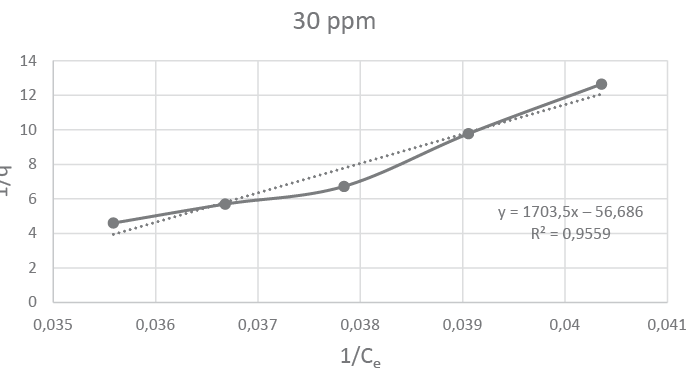
y = 1703,5x − 56,686 |
|
R2 |
0,9687 |
0,9836 |
0,8422 |
0,9559 |
|
Ordenada (1/qmáx.) |
−1025 |
−744,12 |
−176,92 |
−56,686 |
|
Pendiente (1/b * qmáx.) |
10252 |
11063 |
3411,8 |
1703,5 |
|
q máx. |
−0,00097561 |
−0,001343869 |
−0,005652272 |
−0,01764104 |
|
b |
−0,099 |
−0,067 |
−0,052 |
−0,033 |
En esta tabla se presentan los valores de b (afinidad del biosorbente por los iones de Pb) los cuales utilizamos para calcular el RL con la ecuación 4 en la tabla 4 y con la ayuda de la tabla 1 indicándonos que el sistema isotérmico es desfavorable (Ordoñez & Moreno, 2013).
Tabla 4
Valores de b obtenidos por cada concentración con su respectivo RL
|
ppm |
b |
RL |
|
10 |
−0,099 |
5126,000 |
|
15 |
−0,067 |
−111,973 |
|
20 |
−0,052 |
−26,949 |
|
30 |
−0,033 |
583,390 |
A continuación, se muestran las figuras 5, 6, 7 y 8 que corresponden a las isotermas de Langmuir para las concentraciones de 10, 15, 20 y 30 ppm de Pb, respectivamente. En ellas se pueden observar que el mayor coeficiente de correlación (0,9836) lo obtuvo la isoterma con concentración de 15 ppm.
Figura 5
Isoterma de Langmuir para el reactor D
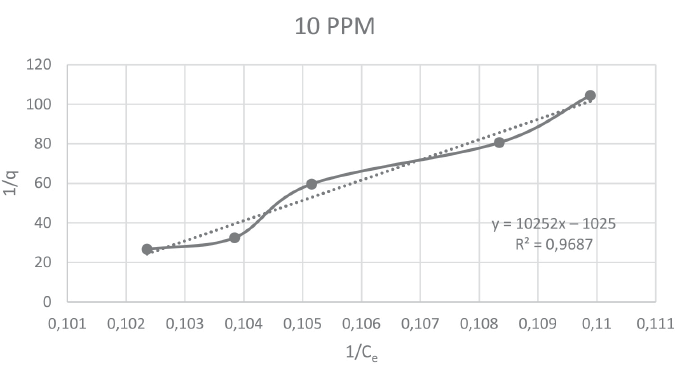
Figura 6
Isoterma de Langmuir para el reactor D
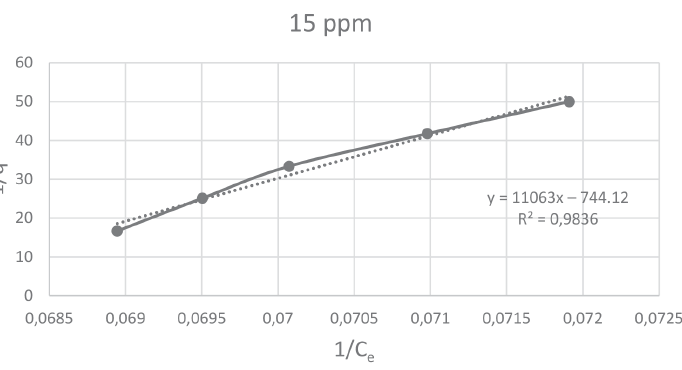
Figura 7
Isoterma de Langmuir para el reactor D
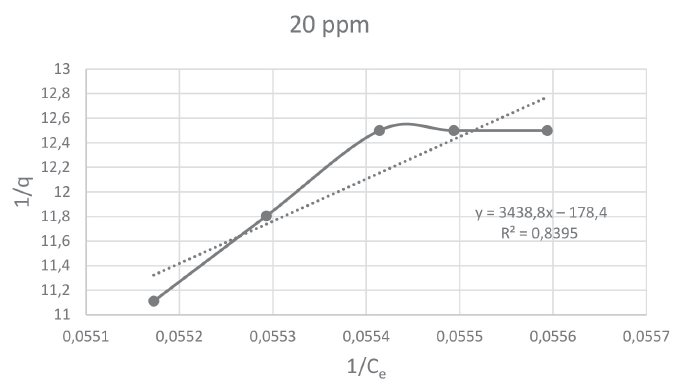
Figura 8
Isoterma de Langmuir para el reactor D
Por último, los resultados del pH obtenido después de 2,5 horas de experimentación para los 4 reactores con las diferentes concentraciones estudiadas se muestran en la tabla 5.
Tabla 5
Valores del pH para la remoción de las concentraciones de Pb estudiadas
|
Concentración |
pH |
|
10 ppm |
2,96 |
|
15 ppm |
2,76 |
|
20 ppm |
2,66 |
|
30 ppm |
2,47 |
4. DISCUSIÓN
La rapidez del proceso de biosorción pudo deberse, principalmente, a que la fijación del metal se lleva a cabo a través de reacciones rápidas y reversibles que ocurren en la superficie del biosorbente y que tienen lugar en ausencia del metabolismo. Esto se puede explicar porque la química acuosa del ion metálico es el rol más importante que desempeña el pH en la adsorción de iones metálicos. Los metales de transición, entre los cuales se encuentran la mayoría de los metales pesados, se caracterizan por su habilidad en la formación de complejos de coordinación con ligandos que poseen pares de electrones libres. La molécula de agua es un excelente ligando y la formación de aquo-complejos es inevitable. A mayor número de ligandos rodeando un catión metálico, mayor será su radio iónico y su volumen, convirtiéndolo al catión en una especie estéricamente impedida para una eficiente interacción con la superficie del adsorbente. La formación de complejos con el agua es regulada por el pH, ya que, a altos valores de pH, la concentración de iones oxhidrilo aumenta en la solución y es capaz de formar hidroxo-complejos, los cuales no solo aumentan el volumen del catión, sino que disminuyen su carga neta, disminuyendo también su afinidad con el adsorbente (Cuizano et al., 2010).
Mediante estudios de especiación química en soluciones acuosas, ha sido demostrado que el ion Pb (II) se mantiene en su forma Pb (II) como especie predominante hasta pH 4, pH al cual la especie Pb (OH)− (complejo mono acuo plumboso) aparece como nueva especie emergente (Cuizano et al., 2010).
Por otro lado, para obtener las isotermas de Freundlich se graficaron los datos del logaritmo base 10 de la concentración en el equilibrio (log Ce) versus el logaritmo de la capacidad de adsorción de Azolla caroliniana (log q). Los valores numéricos relacionados con la afinidad del bioadsorbente por los iones metálicos K (L/g) y el parámetro afín con la intensidad de la absorción (n) fueron obtenidos de la pendiente y la intersección de la forma lineal de la isoterma de Freundlich (Herrejón et al.,2008).
5. CONCLUSIONES
A partir de las isotermas de Langmuir para cada uno de los reactores se pudo determinar la concentración en el equilibrio (Ce) y la carga máxima (q) de plomo adsorbida por Azolla. No obstante, a partir del parámetro RL se determinó que para los 4 reactores el sistema isotérmico era desfavorable para este modelo cinético (RL’s mayor a 1).
Por su parte, las isotermas de Freundlich para los 4 reactores permitieron establecer los modelos lineales del comportamiento cinético de la adsorción de plomo mediante Azolla a través de 4 ecuaciones de la recta, obteniendo el mejor R2. En este sentido, podemos concluir que el proceso de adsorción de plomo por Azolla se produce mediante este modelo cinético, donde la mayor intensidad de adsorción (n) de Pb fue de 0,122 para el reactor D (30 ppm de Pb).
REFERENCIAS
Ahmady-Asbchin, S., Nasrollahi, A., & Jafari, N. (2012). Potential of Azolla filiculoides in the removal of Ni and Cu from wastewaters. African Journal of Biotechnology, 11(95), 16158-16164. https://www.ajol.info/index.php/ajb/article/view/129788
Altamirano Pavón, M. (2015). Remoción de Pb (II) por medio de adsorción en quitosano [Tesis de grado, Universidad de Veracruzana].
Barceló, J., & Poschenrieder, C. (2003). Phytoremediation: principles and perspectives. Contributions to Science , 2(3), 333-344.
Bennielli, R., Stepniewska, Z., Banach, A., Szajnocha, K., & Ostrowski, J. (2004). The ability of Azolla caroliniana to remove heavy metals (Hg(II), Cr(III), Cr(VI)) from municipal waste water. Chemosphere, 55(1), 141-146. https://www.ajol.info/index.php/ajb/article/view/129788
Carvajal-Bernal, A. M., Gómez, F., Giraldo, L., & Moreno-Piraján, J. C. (2018). Estudio de la adsorción de 4-nitrofenol desde solución acuosa sobre un carbón activado con heteroátomos nitrogenados en la superficie: aplicación del Modelo de Sips. Revista Colombiana de Química, 47(1), 27-33. https://repositorio.unal.edu.co/handle/unal/66255
Cuizano, N. A., Reyes, Ú. F., Domínguez, S., Llanos, B. P., & Navarro, A. E. (2010). Relevancia del pH en la adsorción de iones. Revista de la Sociedad Química del Perú, 76(2), 123-130.
Dávila Molina, C. G., & Bonilla, P. (2011). Optimización del proceso de adsorción de plomo con quitosano modificado para ser utilizado en el tratamiento de aguas. Química Central, 2(1), 19-22. https://doi.org/10.29166/quimica.v2i1.542
Herrejón, M., Limón, B., & Martínez, V. (2008). Cinética e isotermas de adsorción de Pb (II) en suelo de Monterrey. Ingenierías, 11(41), 24-31. http://eprints.uanl.mx/id/eprint/10396
Maldonado, A., Luque, C., & Urquizo, D. (2012). Biosorción de plomo de aguas contaminadas utilizando Pennisetum clandestinum Hochst (KIKUYO). Revista Latinoamericana de Metalurgia y Materiales, 52-57. https://www.rlmm.org/ojs/index.php/rlmm/article/view/347
Ordoñez, J., & Moreno, R. (2013). Estudio del aprovechamiento de residuos orgánicos de cultivos de flores (tallos de rosas) como bioadsorbente de Cd para el tratamiento de aguas residuales [Tesis de grado, Universidad Politécnica Salesiana, Cuenca]. https://dspace.ups.edu.ec/handle/123456789/4272
Ortega, S., & Sánchez, D. (2019). Evaluación de la capacidad de remoción de cromo de Eichhornia crassipes y Azolla sp. con miras a su aplicación como tratamiento complementario de aguas residuales de la industria galvanotécnica [Tesis de grado, Universidad de la Salle]. https://ciencia.lasalle.edu.co/ing_ambiental_sanitaria/1137/
Pérez, L., Salgado, I., Larrea, C., Martínez, A., Cruz, M., & Carballo, M. (2018). Biosorción microbiana de metales pesados: características del proceso. Revista Cubana de CIencias Biológicas, 6(1).
Rai, P. K. (2008). Technical note: Phytoremediation of Hg and Cd from industrial effluents using an aquatic free floating macrophyte Azolla Pinnata. International Journal of Phytoremediation, 10(5), 430-439. https://doi.org/10.1080/15226510802100606
Rodríguez, A., Cuéllar, L., Maldonado, G., & Suardiaz, M. (2016). Efectos nocivos del plomo para la salud del hombre. Revista Cubana de Investigaciones Biomédicas, 35(3), 251-271. https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=70505
Saeed, A., Akhter, M., & Iqbal, M. (2005). Removal and recovery of heavy metals from aqueous solution using papaya wood as a new biosorbent. Separation and Purification Technology, 45(1), 25-31. doi:https://doi.org/10.1016/j.seppur.2005.02.004
Sánchez, N., Subero, N., & Rivero, C. (2011). Determinación de la adsorción de cadmio mediante isotermas de adsorción en suelos agrícolas venezolanos. Acta Agronómica, 60(2), 190-197. https://www.redalyc.org/articulo.oa?id=169922373011
Sharma, P., & Dubey, R. (2005). Lead toxicity in plants. Brazilian Journal of Plant Physiology, 17(1), 35-52. http://dx.doi.org/10.1590/S1677-04202005000100004
Shmaefsky, B. (2020). Phytoremediation. Concepts and strategies in plant sciences. Springer, Cham. https://doi.org/10.1007/978-3-030-00099-8
Siccha, A. (2012). Eficacia de la biosorción de Plomo mediante cochayuyo pre-tratado (Chondracanthus chamissoi) [Tesis de grado, Universidad Nacional del Callao]. https://www.unac.edu.pe/documentos/organizacion/vri/cdcitra/Informes_Finales_Investigacion/Febrero2012/IF_SICCHA%20MACASSI_FCS.pdf
Suthar, V., Memon, K., & Mahmood-ul-Hassan. (2014). EDTA-enhanced phytoremediation of contaminated calcareous soils: heavy metal bioavailability, extractability, and uptake by maize and sesbania. Environmental Monitoring and Assessment, 186(6), 3957-3968. https://doi.org/10.1007/s10661-014-3671-3
Tejada-Tovar, C., Villabona-Ortiz, A., & Garcés-Jaraba, L. (2015). Adsorción de metales pesados en aguas residuales usando materiales de origen biológico. Tecno Lógicas, 18(34), 109-123.
Tejada-Tovar, C., Villabona-Ortiz, Á., & Núñez-Zarur, J. (2015). Uso de biomasas para la adsorción de plomo, níquel, mercurio y cromo. Ingenium, 9(24), 41-51.
Tur-Naranjo, L. E., Orberá-Ratón, M. T., Romagosa-Álvarez, Y., & Pérez-Silva, D. R. (2013). Bioadsorción de plomo (II) por biomasa microbiana seca: Efecto del pH. Revista Cubana de Química, XXV(1), 75-81. https://www.redalyc.org/articulo.oa?id=443543730010
Vallejo, M. (2021). Utilización de Lacasa de Pleurotus ostreatus y su biomasa residual para la degradación de colorantes azoicos y la remoción de metales en aguas residuales [Tesis de doctorado, Benemérita Universidad Autónoma de Puebla]. https://hdl.handle.net/20.500.12371/12695
Villalón, M. F., Lamela, O. C., Adrian, D., & Silva, R. M. (2018). Factores de mayor influencia en la adsorción de metales pesados por biomasa seca de Kluyveromyces Marxianus CCEBI 2011. Tecnología Química, 38(2), 335-345.
Vizcaino Mendoza, L., & Fuentes Molina, N. (2015). Biosorción de Cd, Pb y Zn por biomasa pretratada de algas rojas, cáscara de naranja y tuna. Ciencia e Ingeniería Neogranadina, 25(1), 43-60.